1. Reação de Substituição
Por vezes, uma substância reage com um composto expulsando parte desse composto. Chama-se a isto reação de substituição. O metal zinco, por exemplo, reage com o ácido clorídrico para substituir o gás hidrogénio. Isto acontece porque existe uma atração mais forte entre o zinco e o cloro do que entre o hidrogénio e o cloro. Um átomo de zinco pode fornecer um eletrão a cada um de dois átomos de cloro. O zinco e o cloro tornam-se iões e ligam-se entre si. Os átomos soltos de hidrogénio são expulsos. Ligam-se em pares covalentes e afastam-se. Como se passam as coisas:
Etapa 1: Duas moléculas de ácido clorídrico (cloreto de hidrogénio) encontram um átomo de zinco.
Etapa 2: O átomo de zinco separa cada uma das moléculas (cada molécula de cloreto de hidrogénio é revertida a um átomo de cloro e a um de hidrogénio) e dá um eletrão a cada átomo de cloro.
Etapa 3: No final da reação, fica uma molécula de cloreto de zinco e uma molécula de hidrogénio.
Os químicos dizem que o zinco "substitui" o hidrogénio. Eis como se apresenta a equação:
Zn + 2HCl = ZnCl2 + H2
2. Reação de Decomposição
Se um composto dispuser de energia suficiente, pode por vezes decompor-se para criar sozinho novos produtos. Ocorreu uma mudança química chamada decomposição. Por exemplo, quando o carbonato de cálcio é aquecido, cinde-se para formar óxido de cálcio e dióxido de carbono gasoso:
CaCO3 + energia = CaO + CO2
3. Reação Reversível
Por vezes, os reagentes formam novos produtos, vindo esses produtos a reagir conjuntamente e regressando às substâncias originais. Chamam-se a estas reações reversíveis. Como podem repetir-se continuamente para trás e para a frente, estas reações nunca se concluem verdadeiramente. Por exemplo, se se aquecer dióxido de azoto, este divide-se em monóxido de azoto e oxigénio. Trata-se de uma reação de decomposição, mas é também reversível. Quando os produtos arrefecem, reagem uns com os outros para voltar a formar dióxido de azoto. A chave é o calor. Se os produtos permanecerem suficientmente quentes, a reação de reversão não pode ocorrer. Esta equação tem uma seta a apontar para ambos os lados, para mostrar que a reação é reversível:
2NO2
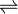 2No + O2
2No + O24. Reação Redox
Algumas reações são constituídas por duas "meias" reações em que os reagentes perdem e adquirem eletrões. Um reagente perde eletrões - chama-se a isto oxidação. Os outros reagentes ganham esses eletrões - trata-se da redução. Em conjunto, a oxidação e a redução produzem imensos iões - que são atraídos entre si e se ligam, formando produtos. O processo global denomina-se reação redox (abreviatura de reação redução/oxidação). Uma reação redox comum é a que ocorre entre o cálcio e o cloro. A reação pode ser mostrada como duas meias equações ou uma equação completa:
Meia reação de oxidação:
Um átomo de cálcio perde dois eletrões
e torna-se um ião, que se representa por Ca ----> Ca2+ + 2e-
Ca2+. O cálcio é "oxidado".
Meia reação de redução:
Uma molécula de cloro recebe esses dois
eletrões e transforma-se em dois iões, que Cl2 2e- ----> 2Cl-
se representam por 2Cl-. O cloro é "reduzido
Reação redox global:
Os iões de cálcio (Ca2+) ligam-se com
os iões de cloro (Cl-) para formar o Ca + Cl2 ----> CaCl2
produto final: cloreto de cálcio.
O cloreto de cálcio é um pó não reativo, bom para absorver água. Por vezes é usado como conservante alimentar. Os químicos usam-no nos laboratórios para proteger substâncias reativas da humidade do ar.
O fenómeno de algo a arder; ou combustão, como os químicos gostam de lhe chamar, é a mais famosa de todas as reações redox. Por eemplo, no motor de um foguete, o hidrogénio arde com oxigénio. Uma faísca desencandeia a reação entre os dois gases, que se mantêm a arder até que um deles esgote. A reação liberta uma quantidade tremenda de calor e força que projeta o foguete para o espaço.
Meia reação de oxidação: Meia reação de redução:
2H2 ----> 4H+ + 4e- O2 + 4e- ----> 2O2-
Reação redox global:
2H2 + O2 ----> 2H2O
O hidrogénio é oxidado e o oxigénio é reduzido.
As reações redox são também o segredo por trás do fogo-de-artifício. O fogo-de-artifício contém uma mistura de metal e de outros compostos que produzem oxigénio depois de ateados. O oxigénio reage com o metal, fazendo-o arder com uma chama colorida. Vê a equação para a reação que ocorre num foguete azul, fabricado com cloreto de cobre:
Meia reação de oxidação: Meia ração de redução:
4Cl- ----> 2Cl2 + 4e- O2 + 4e- ----> 2O2-
Reação redox global:
4CuCl + O2 ----> 2Cu2O + 2Cl2
O cloro é oxidado e o oxigénio é reduzido. O cobre começa por estar ligado ao
cloro e acaba ligado ao oxigénio - portanto mudou - , mas não foi oxidado nem reduzido.
5. Reação de neutralização
Ainda outra reação ocorre quando um composto denominado base é misturado com um composto denominado ácido.
O que é um ácido?
Os ácidos variam entre ácidos fracos - como o ácido cítrico, de sabor amargo, que existe no sumo do limão e da laranja - e fortes, como ácido sulfúrico usado nas baterias dos automóveis. Muitos ácidos fracos são usados como tempero. Os ácidos fortes são em geral venenosos e também corrosivos, o que significa que podem provocar queimaduras. Os químicos definem ácido como uma substância que produz iões positivos de hidrogénio (H+) quando dissolvida em água. A força de um ácido depende da proporção das suas moléculas que se decompõem em iões.
O que é uma base?
Uma base é o oposto de um ácido. Na água produz iões negativos de hidróxido (OH-). Tal como os ácidos, as bases podem ser fortes ou fracas. Bases fracas, como o bicarbonato de sódio, são comestíveis, apesar de não serem muito saborosas. Bases fortes, como o líquido para limpar o forno, são tão corrosivas como ácidos fortes. Quando uma base é dissolvida em água, dá-se-lhe o nome de solução alcalina.
Quando um ácido e uma base são misturados na quantidade adequada, reagem para formar água e um sal. O sal de mesa (cloreto de sódio) é apenas uma variedade de sal. Os sais não são ácidos nem bases: são neutros. Daí que se chame reação de neutralização a este tipo de reação. Esta equação mostra a reação de neutralização entre o hidróxido de sódio (uma base) e o ácido clorídrico, que produz sal de mesa e água:
NaOH + HCl ----> NaCl + H2O
Quando os ácidos e as bases se misturam, nem sempre formam um produto neutro. Se, por exemplo, misturares uma base forte, como o hidróxido de sódio, com um ácido fraco, como o carbonato de hidrogénio, forma-se uma base fraca: o bicarbonato de sódio, mais conhecido por fermento em pó:
NaOH + HCO3 ----> NaHCO3 + H2O
Do mesmo modo, juntar um ácido forte a uma base fraca resulta num ácido fraco. Por exemplo, o ácido clorídrico e o amoníaco produzem cloreto de amónio - um ácido fraco usado no champô para combater as pontas espigadas no cabelo.
6. Reação de polimerização
Ainda outro tipo de reação é o que é usado nas fábricas que produzem plásticos. Os reagentes são pequenas moléculas que se encontram no petróleo bruto. Calor, pressão e, por vezes, catalisadores levam essas moléculas a reagir para formar cadeias muito longas chamadas polímeros. Os químicos designam-na por reação de polimerização. Todos os plásticos são feitos de polímeros. Alguns polímeros também existem na natureza. Encontram-se em coisas como a lã e o algodão e nos teus cabelos. Diferentes plásticos têm diferentes propriedades, o que os torna úteis para todo o tipo de coisas. Alguns são rijos e fortes, outros flexíveis e leves, e a maioria pode ser modelada para adotar diferentes formas, de utensílios de plástico a brinquedos. O plástico é tão versátil que pode até ser obtido em finos fios e entrançado para criar tecidos leves, quentes e resistentes. A Lycra é um plástico usado em roupa interior e desportiva. O poliéster, outro plástico, pode ser usado em almofadas, e o acrílico é muitas vezes misturado com lã natural para criar malhas quentes.
Génios do Plástico
A maioria dos plásticos que as pessoas hoje usam só foi inventada no século XX:
1908: Leo Baekeland criou a baquelite, usada em rádios e telefones antigos.
1933: Eric Fawcett e Reginald Gibson inventaram o polietileno, excelente para fabricar sacos de plástico.
1935: Wallace Carothers inventou a fibra de nylon, usada no vestuário.
1965: Stephanie Kwolek inventou o Kevlar, que agora é usado em colete à prova de bala.
acho bem pores matéria mas podias por de outras como historia, geografia e etc
ResponderEliminar